- Ferenci Tamás - Megfigyeléses vizsgálatok - www.medstat.hu/oktatas/AzOrvosiMegismeresModszertana/FerenciTamas_AzOrvosiMegismeresModszertana_MegfigyelesesVizsgalatok_lecturenote.pdf
- Ferenci Tamás - Az orvosi megismerés módszertana
- https://catalogofbias.org/
- https://www.consort-statement.org/
- beadandó: 2000 szavas összefoglaló egy dokumentumfilmről
- prezentáció: orvosi cikk prezentálása 10 percben + 5 perc kérdések
- zh
ezek alapján megajánlott jegy, ha ezek nincsenek meg, akkor vizsga
- nov. 4 konzultáció
- nov. 11 zh
- nov. 18 rektori szünet
- nov. 25 előadások part I - clinical trial, observational study
- dec. 2 előadások part II
- dec. 3 videó összefoglaló beadandó határidő
- dec. 9 pót zh
Statisztika: azt méri, hogy amit látok mennyire véletlen eredménye
Nem mindig tudjuk, hogy mi miért működik vagy miért nem, de látjuk és azt bizonyíthatjuk, hogy véletlen esemény-e, pl: lítium kezelés bipolárisoknál
Részei:
- expozíció (adott)
- oksági kapcsolat (keressük)
- végpont (választott)
Nehézségek:
- sztohasztikus értékek: statisztika, stb
- a következményei nem azonnaliak
- ismeretlen mechanikus komponensek: nehezen mérhető, nehezen tanulmányozható területeken, pl. biokémia
- erős hitvilág
- következmények: biztonság, monitorozás
pl:
- A vérnyomás csökkentő csökkenti-e a vérnyomást?
- Császármetszés növeli-e az I. típusú diabétesz kialakulását?
- Expozíció: az amit vizsgálunk (kísérletnél ezt adjuk meg)
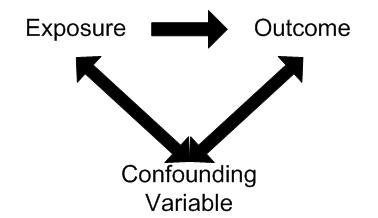
- Confounder: expozíciót és kimenetet is befolyásoló tényező
- Predictor: csak a kimenetre hat (a csoportok randomizációja miatt), gyakorlatilag az expozíciónak való kitettség mértéke
- pl:
- Ha azt szertnénk nézni, hogy a császármetszés milyen kapcsolatban áll a születendő gyermek I. típusú diabéteszével? Ha cserélgetjük ezeket akkor is megfeleltethetőek egymásnak.
- Ha egy magas feszültségű távvezeték közelében levő embereket vetnénk össze belvárosi emberekkel akkor hozzá kell vennünk, hogy nem csak a telkek ára különbözik, de elhelyezkedésük is, mert kevés nagyfeszültségű vezeték megy át városközponton, a terep adottságai mások, más társadalmi réteg tualjdonolja, stb..
- A célunk, hogy a két elkülönített csoport csak a vizsgált célban különbözzön, ne legyen nemi/kor/stb alapú egyéb különbség, akkor sem, ha pl öszesen 30 nő és 2 férfit osztunk szét.
- A kísérleteket vakosítjuk, ha tudjuk, hogy a betegek ne tudják melyik csoportba kerültek.
- 1.vakosítás ha a beteg nem tudja placebo-e a kezelés
- 2.vakosítás ha az orvosa se tudja mit kap a beteg
- 3.vakosítás a statisztikus se tudja kiadó se tudja.
- Ha teljesen random allokállom a csoportokat, akkor előfordulhat, hogy mind egy csoportba kerül!
Oksági kapcsolat Az expozíciónál kitett, vagy nem kitett a két tényező.
blokkosítás:
//Stataban
módszer:
- Minden elem mellé beírok 50 db
A-t és 50B-tABformában- 8 elemenként blokkokra osztom
- minden elem mellé beírok egy random számot [0,1] intervallumból
- blokkonként növekvő sorrendbe állítjuk
=> ezzel az arányt, a vakosítást megtartom
| Tables | Aetiological factors (kórok tana) | Intervention effects |
|---|---|---|
| observational - descriptive | Case studies | Case studies |
| observational - compertive | Case-control cohort | histroically controlled rials |
| experimental intervention | rare,excepts prevention trials | (randomised) controlled trials |
- megfigyeléses vizsgálat
- cohort vizsgálatok:
- csoportokat képzünk egy közös faktorból (valami alapján csoportosítható, pl valaminek ki van téve vagy valaminek nincs)
- múltbeli faktor alapján kezdjük a vizsgálatot
- nagyszámú beteget vizsgál
- retrospektív ha a vizsgálat már meglévő adatokat elemez ki, korábban valmaiért begyűjtött adatokon alapul => hosszútávú megfigyelést is végre tud hajtani, viszonylag olcsón, de az expozíciónak való kitettség nem egyértelmű mindig
- prospektív ha előre elterveztük a vizsgálatot és kb labor körülmények között hajtjuk végre, imsert populáción, kontrollált, szűrt bemenettel, várható kimenettel.
- náluk próbálok egy közös jellemzőt találni, hogy a betegségben szenvedőknél is így alakul-e?
- oksági kapcsolatokat alakítunk ki
- eset kontroll:
- csoportosítunk
- a csoportok közti hasonlóság és eltérés vizsgálata
- pl:
- tüdőrák kockázata nő a dohányzással
- Nun study
- cohort vizsgálatok:
- leíró
- hipotéziseket generál
- ritka, hosszú távú hatásokat is megfigylehet
- Majdnem 700 amerikában élő katolikus apáca felajánlotta, hogy az agyukat szövetttani vizsgálatoknak ki lehet tenni, ezáltal egy homogén csoportot képezve. A vizsgálat elindult, és összehasonlították a tüneteket neuropatológiai szövetekkel.
- Ez egy esetkontroll vizsgálat, retrospektív, cohorttal.
Boncolás után találtak olyan eseteket ahol erős Alzheimer társult ép agyi szövetekkel, illetve erősen roncsolt szövetek előzetes tünetek nélkül.
Korrelációt találtak szókincskészlettel: ezek alapján akinek gazdagabb szókincse volt később jelentkeztek nála tünetek.
- expozíció: öregedés
- confounder: az összes egyéb dolog, pl milyen teát isznak az apácák, mennyit alszanak, stb
- az időbeli egymásutániságot az ember ok-okozati összefüggésnek hajlamos értelmezni
- az emlékezet torzíthatja a tényeket
- számít-e hogy hol laknak a figyelt alanyok? (nem, ha pl földrészekről van szó)
- false adataok
- torzított adatok (kimaradnak részletek)
- oka lehet emlékezet vesztés, gyenge memória, betegség státusz, edukáltság, kor
- hibás következtetéshez vezet
- olyan esetekben fordul eló amikor a résztveevők memóriájára, információ szolgáltás készségére támaszkodik a felmérés, case-control vizsgálat vagy retrospektív vizsgálat esetén.
- a populáció sokszínűsége (teljesen különbözhet a vizsgált populációtól!)
- a kiválasztás alapján lehet különbség
- ugyanaz a kórház/intézmény dolgozói lettek megkérdezve
- inividual based studies
- mi az alany elő- és utóélete
- milyen nagy a populáció
- statisztikailag a teljes populációban, nem is feltétlen a mintában hány beteg van(prevalencia), jelenleg kezelt betegek száma
- hány új beteg jelenik meg (incidencia), mennyit fogunk kezelni adott betegséggel
Ökonómiai tanulmányok: Két azonos területen mért adat összehasonlítása, pl: GDP - egészségügy / országokra lebontva
- nem érintett a kliválasztástól, ebben a teljes populáció benne van
- nagy a confounding, mert az egész populáció benne van
- ami egyéni szinten igaz nem lesz igaz térségi szinten
Cikk felépítése:
bevezető: milyen bias van az adatokon?
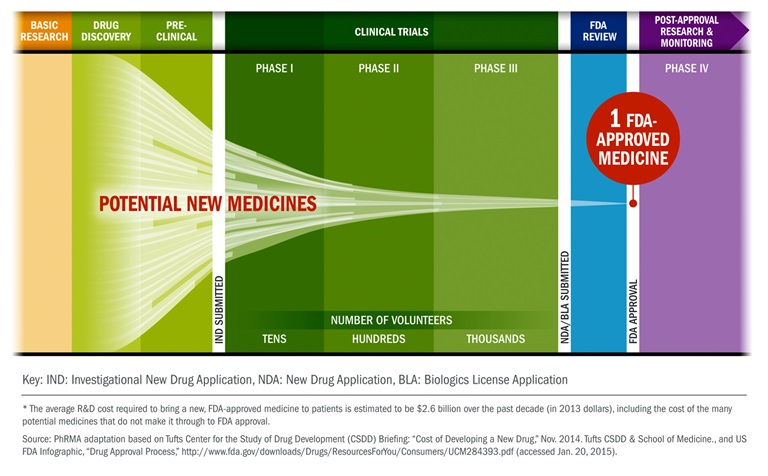
- Pre-clinical research and development
- itt történik a fejlesztés maga, a biokémiai varázslat
- 1. fázis
- biztonságos-e a készítmény
- kontrollált
- gyakori mellékhatás
- a 3 beteg egy csoportban jelemző a területre
- dózis vizsgálat
- van kontroll csoport
- belefér a rosszulét/hányás
- 2. fázis
- a maximum tolerálható dózis meghatározás
- a betegek nem egyszerre kapják a gyógszert
- nincs kontroll (nem érdekel, hogy hánynak-e)
- 3. fázis
- van kontrollcsoport
- törzskönyvezés
- engedélyezés folyamata
- randomitált kontorollált
- néhány száztól néhány ezerig a vizsgált csoport
- 4. fázis
- már kint van a piacon
- hosszútávú mellékhatások mérése
- ritka mellékhatások keresése
- engedélyezett
- költséghatékonyságot is vizsgálják
- nehéz kontorollcsoportot kialakítani, mert hosszú távon, könnyen lehet, hogy más az adott kezelést érintő szert is szed a beteg (akár nem szándékosan)
- Clinical research and development
- miképp használják a szert az orvosok
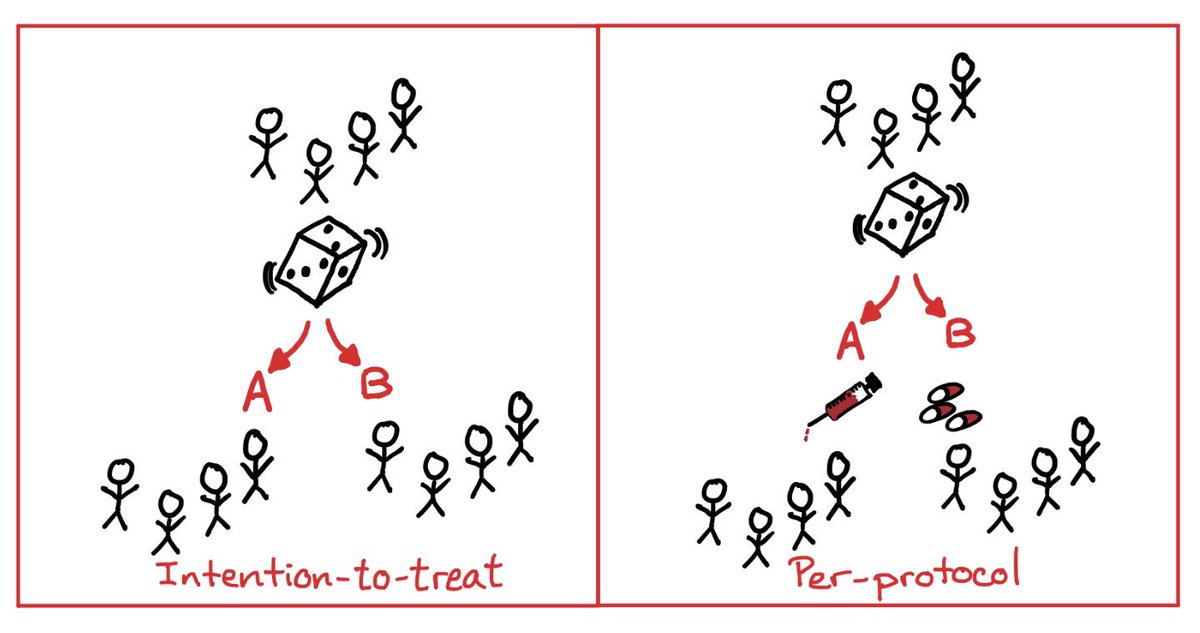
- per protocol: van egy mintám amit randomizálok
AésBcsoportba,Aprotokollal azt mondjuk, hogy az adott csoportban a kezelést úgy hasonlítjuk össze, hogy ahol tényleg megtörtént és úgy történ meg ahogy le van írva, és az alapján újabb két-két csoportot alkotunk. Tehát csak az eljárásnak megfelelően kezelt betegek vannak beszámíva.- intention to treat (ahogy randomizálásra kerül): nem vesszük figyelembe azt, hogy mi történt a két csoportban, csak az egyiket választjuk fő elemzésnek és összehasonlítjuk a másikkal. Tehát minden randomizált beteg bele van számolva akkor is ha nem kapott kezelést!
A két módszer összehasonlításával megkapjuk mennyire van értelme az eljárásnak.
pl:
- szőrös karú embereknek kellemetlen a ragtapasztól amt feltennének
- intetnion to threat: ha kevés a szőrös karú ember akkor ez a szám érdekel, mert a teljes populáción méri mennyire hasznos az eljárás
- per protocol: csak a vizsgált subpopuláción érdekel mennyire működik, tehát szőrös karúaknál mennyire kellemetlen, ha sok a szőrös karú egyébként a populációban
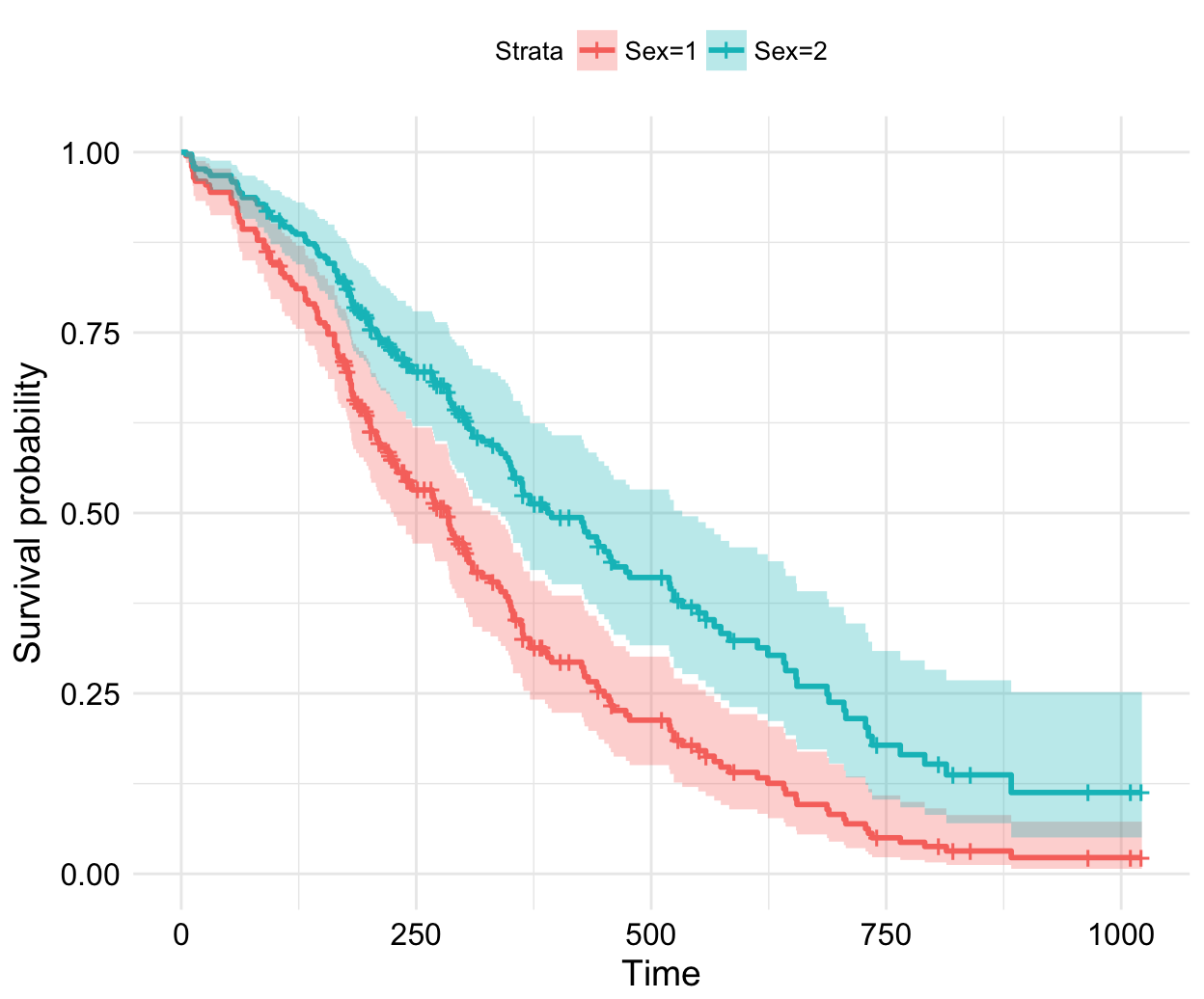
túlélés esélye:
élő_populáció / teljes_populációfeltételes valséggel megadotttúlélés:
előző_lépésben_a_túlélés_esélye * jelenleg_a_túlélés_esélyeMennyi a túlélés esélye: vesszük az utolsó pontot ahonnan már senki nem halt meg és az ott lévő feletételes valséggel megadott értéket
Censoring: azon betegek akiket megfigyletem de egy idő után már nem, tudom megfigyelni, vagy elköltözik, vagy más okból azt ki kell vennem az adatsorból. Ekkor a nevezőt csökkentjük. Ha valaki meghalt a kezelés közben akkor a számlálót.
| ID | túlélési idő (hónapokban) | élő(0) vagy halott (1) | populációszám | események száma | a túlélés vlsége eddig az időpontig | feltételes valség eddig az időpontig |
|---|---|---|---|---|---|---|
| 1 | 2 | 1 | 6 | 1 | =5/6 | = 5/6=0.8333 |
| 2 | 5 | 1 | 5 | 1 | =4/5 | = 0.8333 * 4/5 = 0.6667 |
| 3 | 8 | 0 | 4 | 0 | =4/4 | = 0.6667 * 4/4 = 0.6667 |
| 4 | 12 | 1 | 3 | 1 | =2/3 | = 0.6667 * 2/3 = 0.4444 |
| 5 | 13 | 0 | 2 | 0 | =2/2 | = 0.4444 * 2/2 = 0.4444 |
| 6 | 26 | 1 | 1 | 1 | =0/1 | = 0.4444 * 0/1 = 0 |
pl:
- a 12. hónapig a túlélés esélye: 0.4444
- a 13. hónapig a túlélés esélye: 0.4444, mert nem hal meg senki 12. és 13. hónap között!
kihat a túlélésre: nem, kor, stb
A végső arány amit kapunk, az a hazard ratio.
Szűrővizsglatoknál gyakori
mennyien halnak meg amúgy is miután hatott a kezelés
Jól látszik, hogy attól, hogy hamarabb detektálom, nem növeli meg az életminőséget.
per protocol jellegű
egy kezelés amire várni kell valamennyit
- nominális skála: legtöbbször string, valaminek a neve
- ordinális: valmai alapján sorrendbe tehető string nagyváros, kisváros, község, falu, tanya
- intervallum: számszerű, sorrendbe tehető és a kivonás értlemezett művelet
- arány: mint az inteervallum csak van 0 érték
betegség: az egészség hiánya
egyéni szemlélet alapján: ha én betegnek érzem magam de orvoshoz nem kell mennem társadalmi szempont alapján: ha egészségügyi kapacitást, erforrást foglalok
életjelek: olyan mérhető jelek amik ha szélsőséges értéket érnek el, pl 0 akkor azt modnjuk nincs élet. Ilyenek a: vérnyomás, kor, tömeg, BMI
- arány/intervalllum skála
- nem jó dolog kategorizálni, hiszen ha határt vonunk 30-nál akkor 29.9999 és 30.00001 között a kategória miatt akkora különbség lesz mintha 29.9999 és 36 között
biomarkerek: olyan sejtek amikkel képesek vagyunk egy betegséget detektálni.
- drága
- nem bináris érétkű, nagy skkálán mozog
- prediktorok és végpontok egyszerre
- pl: spirometria
beteg által rögzített végpontok:
- frissen merült fel mint nézőpont
- saját bevalláson alapuló
- Quality of Life
- 5D: mennyire van fájdalma, mennyire képes önálló életre, mennyire jó a mentálsi állapota, mennyire jól alszok, mennyire érzi jól magát és szocializálódik
- [negatív érték, 1+]
- QALY - Quality Adjusted Life Year életminőséggel súlyozott életév:
QoL-el kapott szám * elvesztett_vagy_megnyert_eletevek- Hamilton - D hasonló mint a QALY
- VAS ~ Visual Angle Scale: egy vonalzón mutassa meg a beteg mennyire fáj
- COMET ~ Core Outcome Mesuerements in Effectveness Trials: szakértők és betegek/hozzátartozók rendelnek félelemeket/tüneteket az adott beteséghez
tünetek:
- fronttól a vérnyomás változik
- napi ciklus
- havi ciklus
- biomarkerek false adatai (lyme kór a kezelés után is megőrzi a biomarkerek a betegség jegyeit)
- BMI éves trendje -> télen hízunk
Ha van egy informácink a fluktuációról akkor tudunk egy mintaelem számot számolni, és tudjuk számolni mennyi az esély arra, hogy random-e a fluktuáció.
A szignifikáns különbségek mögött fontos kérdés, hogy hány emberen végzett vizsgálat alapján számoltunk.
- p érték, elütés, adatkezelés nagyobb valószínűséggel add false pozitive-ot mint a mintavételi hibák
binomiális adatgörbénél a nagyság melett a bekövetkezési esély is számít. Ha ritka eseméynt nézek akkor nem nagy a különbség kettő között törvény szerűen.
-
klinikai szignifikancia: tartalmi eltérés
-
p: mértékegység nélküli különbség
-
3Hgmm-el csökkentett magas vérnyomás már populáció szinten, eloszlása jelentős
-
populáció szinten az ami egyéni szinten mérési hibaként is elkönyvelhető, jelentős lehet
konfidencia intervallum: pontbecsléshez hozzárendelt intervallum, pl:95%os konfidencia intervallumon az érték 95%-al beleesik a keresett csoportba
- a biológiai folyamatok fluktuálnak
- ezeknek lehet trendje
- van egy időbeli eloszlása
- ha vágok egyet egy extrém pontnál akkor ha várok egy bizonyos ideig akkor közelíteni fog mindkét irányból => ha egy extrém pontnál vágom el akkor azok a megfigyelések amik alatta vannak közelebb lesznek az átlaghoz.
- de ha véletlen szerűen vágom el akkor gondolhatomm, hogy az egy extrém pont, sőt feltételezhetem, hogy azt kerestem!
a) vérnyomás csökkentő gyógyszerteszthez keresek betegeket akkor ha találok olyant aki 160 Hgmm fölötti sé olyant aki alatti akkor ha az átlag 155 akkor ha legközelebb megfigyelem akkor egy része valószínűelg amgától visszaáll a keveésbé extrém értékre
c) egyetlen beteg vérnyomásának eloszlása, ha 160 HGmm-nél egy beváalsztási kritériumot húzok akkor lehet őt épp elkaptam ennél az eloszlásnál extrémebb résznél, tehát a kevésbé extrémnél is megtalálom majd
Ha egy beteg állapotot nézünk akkor az minidg egy kicsit extrém, tehát ha beteg akkor az ő bináris állapotát valamilyen folytonos mennyiségből származtatt bináris álllapotokra vonatkoztatjuk. => a beteg ne legyen túl beteg és ne legyen kicsit beteg.
Pl:
- vérnyomás
- depresszió
- fájdalom
A variabilitással mérhetjük az időbeli változását. Ha tudok a jelenségről, és egy szeméylnél tudom a varianciát akkor azt tudom, hogy mennyire variábilis a pulációra.
alábecsült a klinikai teszteknél : egy kezelésbe vetett hitem miatt kiváltott hatás
no intervention = regression to the mean
ha lemérek egy átlagtól eltérő csoportot és később újramérem akkor utána az átlaghoz fognak húzni, a különbség ami ekkor jelenik meg a regression to the mean
ha placebo kontroll csoportot adok meg akkor a placebo hatáshoz hozzáadódik a regression to the mean
ha van egy kezelt kontroll csoport akor azoknál a kezelés hatása is megjelenik
=> egyszerre jelenik meg a placeb, akezelés éa sregression to the mean
- nem kell reprezentatív legyen a minta ahhoz, hogy egy kísérleti eredmény számszerűleg valid legyen**!**
- ha egy statisztikai kérdést nézünk populációra vonatkozóan akkor annak egyeznie kell az általunk elvárt populációhoz
DE
- ha a populációt nem akarjuk másiokhoz hasonlítani
- irreleváns a hajszíne, stb
- releváns: a kora, elhízás, neme, stb => ez a kockázata
a kockázata másmilyen, mint a mi áltlaunk mért populáció akkor nem reprezetnatív a mintánk egészségügyi szempontból
Minden statisztikai vizsgálat a vizsgált szempont alapján kell reprezentatív legyen.
Risk ratio: mekkora esélyem van a másik csoportban meggyógyulni, azaz a treated/control: megtörtént/1
Odds ratio: mekkora esélyem arra, hogy odds skálán meggyógyuljak p/(1-p), azaz kiszámolom ezt a törtet mindkét csoportra majd a kettőt elosztjuk megtörtént/(1-megtörtént)
ARR = absolute risk reduction = a két risket kivonom egymásból RD = risk differnece
Egy jó leírás: When to use the odds ratio or the relative risk?
A kezelés odds ratioja átvihető egyik populációról másikra!
Ha kontextusa más a mérésnek és a viszonyított populációnak, így más lesz a végeredmény.
Ha a populációban jelentős a különbésg valamilyen téren akkor jó esélyel nem lesz megfelelő egy másik populációra, pl: ezért más a koncnetráció megy más génállományú betegekbe
A nem reprezentativitás a csak a háttérkokckázat szempontjából számít.
zh kérdés: Mi a három hatás ami megjelenhet a csoportoknál? Regression to the mean, placebo hatás, kezelés hatása. kivétel: interakció, más a populáció, más a kezelés
film link:
filmmel kapcsolatos kérdések:
- milyen új dolgot hallottál
- hogyan és mi alapján történik döntéshozatal 1-1 kezelés kapcsán
- hogyan zajlik döntéshozatal Magarországon
- mi az előnye/hátránya
- milyen kezelés lehet kiugróan költségkímélő
- hogy döntöttél volna szavazáskor
- mi nem hangzot el a filmben?
A protokoll a kísérlet írásos terve ami mindenre megszületik a kísérlettel kapcsolatban. Ezzel lehet pályázni kísérletekhez támogatásért.
A tervel illik transzparensnek lenni, ez íratlan szabály.
- Ez a legfrisseb verzió?
- Milyen változtatás született a verziók között (change log)
- Good clinical prctice filozófia követése
- good clinical prctice: *Egy egészségügyi leírás csomag, amiben protokollok vannak csomagokba gyűjtve. *
- A bevezető fontos, főleg olyanoknak akiknek nincs az adott szakmában közvetlen háttértudásuk.
- Mekkora a társadalmi fontossága? Mennyi embert érint, érinteni fog, stb?
- Szükséges erőforrás becslés (hány nap kórházi ellátás, mennyi embert érint, munkaórák, stb.)
- Mit érhetünk el?
- Hol és mekkora kontrollcsoportunk van?
- Risk assesment az etikai bizottság felé, amennyiben érintett a kérdés, pl. halálozás esetén.
- Trial design: minnél szélesebb legyen, hogy a végeredmény jól kezelhető legyen.
- A beteg legyen tényleg beteg.
- Kizáró kritériumok: kor, terhesség, alkoholizmus, stb.
- Stopping rules: DMEC - TSC dönt, hogy helyes-e a kísérlet
- recruitment nem jön össze
- biztonsági okok
- Kezelések: bemutatja mondjuk egy gyógyszer hatásait, lefolyását, stb.
- mi számít tényleg kezelésnek és miképp lesz mérve?
- Végpontok: megfogalmazza a várt kimeneteket
- Mellékhatás:
- kedvezőtlen esemény (AE), nem kell közvetlen kapcsolatban legyen a kezeléssel. Hogy ok-okozati összefüggés van-e, azt később döntik el. Valami betegésgre jellemző eseményt lehet, hogy nem kell feltüntetni, ezt is itt határozzák meg.
- fontos kedvezőtlen eseményt (SAE) azonnal jelenteni kell a hatóságoknak, akár halállal is járó mellékhatás lehet
- Protokoll: vannak-e farmatokinetikai mérések
- ha csak nem kifejezetten ezzel foglalkozunk akkor a statisztikai szempontból nem lényeges
- Vizit leírása
- Statisztikai összefoglaló: milyen módszert alkalmaztak és hogy mérték, mi van a hiáynzó adatokkal
- Betegek informálása, stb.
Első szintű vakosítás: a beteg ne tudjon arról, hogy mit kap.
Kettős vak a vizsgálat: a gyógyszertátban aki átadja a gógyszert ne tudja mit ad át, az orvos, és a kezelő személyzet se tudja, hogy a beteg mit kap.
Hármas vakosítás: a statisztikus se tudja ki milyen csoporthoz tartozik.
- 1995 számít a vakosítás
- 200 nem számít
- 2001 számít
Miben más az orvostudománnyal kapcsolatos kutatás más tudományágakhoz képest?
nem olyan értelemben kell reprezentatív legyen mint a szokásos gazdasági statisztikai modelleknél
Mit jelent a p-érték és mit jelent a 95%-os konfidencia intervallum?
- p: mértékegység nélküli különbség; annak a mértékegysége, hogy a H0 mennyire véletlen?
- konfidencia intervallum: megbízhatósági szint; pontbecsléshez hozzárendelt intervallum
Mit jelent, ha a p érték = 0.001 és ha pl.:0.439?
p = 0.001- 0.1% esélye van annak, hogy H0 igazp = 0.439- 43.9% esélye van, hogy H0 igazA szignifikancia szintet ehhez hozzáadhatjuk esetleg, de az egy trashold ami +/- ingadozáskénét értendő
placebo hatás és regression to the mean példák
placebo - anynyira erős a hit a gyógyszerben, hogy idieglenes javulást mutat
regression to the mean - ha egy extrém pontnál vágom el akkor azok a megfigyelések amik alatta vannak közelebb lesznek az átlaghoz; a test különböző mérhető adatai amúgy is fluktuálnak, ha egyszer megmérem a vérnyomást és átlag fölötti a következő alaklaommal valószínűelg átlaghoz közelebbi lesz.
- Visszatérés az átlaghoz
- Visszatérés az átlaghoz + placebo
- Visszatérés az átlaghoz + placebo + kezelés
mi a confounding, pl?
expozíciót és kimenetet is befolyásoló tényező megjelenése, ami akár hatással is lehetne és akár zt is vizsgálahatnánk de nem az a vizsgáalt tárgya.
pl: nun studynál minden amit az apácák fogyasztottak pluszban, vagy napi rutinjuk vol, vagy ha azt szertnénk nézni, hogy a császármetszés milyen kapcsolatban áll a születendő gyermek I. típusú diabéteszével? Ha cserélgetjük ezeket akkor is megfeleltethetőek egymásnak.
sztohasztikus értékek: statisztika, stb
a következményei nem azonnaliak; ismeretlen mechanikus komponensek: nehezen mérhető, nehezen tanulmányozható területeken, pl. biokémia, erős hitvilág
következmények: biztonság, monitorozás